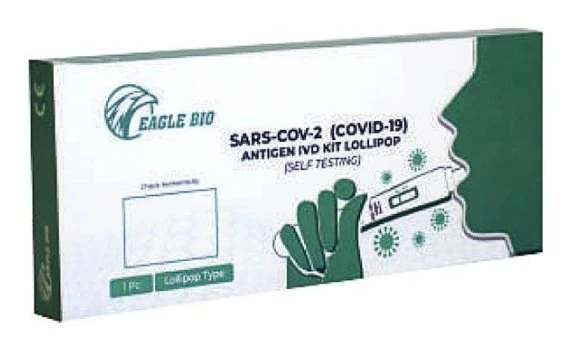
醫管局撤銷Eagle Bio棒棒糖自檢試劑盒批准
(吉隆坡23日訊)馬來西亞醫療器材管理局(MDA)首席執行員阿末沙里夫透露,該局已撤銷一款由中國製造的新冠肺炎自檢試劑盒的有條件批准。
他表示,這款名為Eagle Bio的棒棒糖型(Eagle Bio SARS-CoV-2 Antigen IVD Kit Lollipop)自檢試劑盒,是該局撤消上架批准的第3款自檢試劑盒品牌,另外已被撤消上架批准的兩款自檢試劑盒,是由Innovac Technology私人有限及Conan Medical Technology有限公司所進口。
 阿末沙里夫接受《今日自由大馬》(FMT)訪問指出,當局在本周也將會致函予給另外4家公司,以要求他們在對公司研發的自檢試劑盒出現的錯漏進行進一步的更正及調查。
阿末沙里夫接受《今日自由大馬》(FMT)訪問指出,當局在本周也將會致函予給另外4家公司,以要求他們在對公司研發的自檢試劑盒出現的錯漏進行進一步的更正及調查。
「我們一直都有在實地收集樣本,並測試它們的有效性。在醫藥器械管理局有條件批准前,自檢試劑盒必須顯示100%的明確性和至少90%的敏感性。」
他說,若某個自檢試劑盒不符合要求,當局將要求公司對此進一步調查並採取糾正措施。
「若公司按照指示完成,而結果仍是不滿意,我們將撤銷對該產品的有條件批准。」
截2022年7月19日,已有142個新冠肺炎快速抗原檢測試劑盒(RTK-Ag)獲得大馬醫藥器材管理局有條件批准。
分享到







